Antraceen
Antraceen (van het Griekse antrax, hetgeen kool betekent) is een organische verbinding met als brutoformule C14H10. De zuivere stof komt voor als een kleurloze kristallijne vaste stof met een karakteristieke geur, die reeds bij kamertemperatuur licht sublimeert. Antraceen is een aromatische koolwaterstof met drie aromatische ringen die lineair aan elkaar gekoppeld zijn. Het is dus een polycyclische aromatische verbinding (specifiek behoort het tot de acenen). Een andere isomeer met drie aromatische ringen is fenantreen.
| Antraceen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
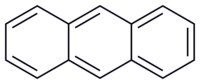
Structuurformule van antraceen
| ||||
| ||||
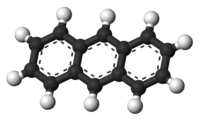
Molecuulmodel van antraceen
| ||||
| Algemeen | ||||
| Molecuulformule | C14H10 | |||
| IUPAC-naam | antraceen | |||
| Andere namen | paranaftaleen | |||
| Molmassa | 178,2292 g/mol | |||
| SMILES | c23cc1ccccc1cc2cccc3
| |||
| InChI | 1S/C14H10/c1-2-6-12-10-14-8-4-3-7-13(14)9-11(12)5-1/h1-10H
| |||
| CAS-nummer | 120-12-7 | |||
| EG-nummer | 204-371-1 | |||
| PubChem | 8418 | |||
| Wikidata | Q422152 | |||
| Beschrijving | Kleurloze sterk geurende kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H410 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 | |||
| Omgang | Niet inademen, aanraking en herhaalde blootstelling vermijden | |||
| Opslag | Stevig gesloten houden, geeft bij brand giftige dampen af | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos-beige | |||
| Dichtheid | 1,25 g/cm³ | |||
| Smeltpunt | 217,5 °C | |||
| Kookpunt | 340 °C | |||
| Vlampunt | 121 °C | |||
| Goed oplosbaar in | benzeen | |||
| Slecht oplosbaar in | hexaan, methanol, ethanol, di-ethylether | |||
| Onoplosbaar in | water | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Geschiedenis
bewerkenAntraceen werd in 1832 voor het eerst geïsoleerd uit teer door Antoine Laurent en Jean Dumas. In 1836 prepareerde Laurent voor het eerst ftaalzuur en antrachinon door de oxidatie van antraceen.
Productie
bewerkenAntraceen wordt direct uit steenkoolteer gewonnen of door de diels-alderreactie van 1,4-benzochinon en 1,3-butadieen. De synthese van antraceen kan tevens uitgevoerd worden door de Elbs-condensatie, dit is de pyrolyse van 2-methylbenzofenon na een Friedel-Craftsreactie met 2-broombenzylbromide. De Friedel-Crafts-acylering wordt ook toegepast in de reactie van benzeen met ftaalzuuranhydride in aanwezigheid van aluminiumchloride. Dit was tevens door oorspronkelijke synthese ontwikkeld door Richard Anschütz in 1883.
Eigenschappen
bewerkenAntraceen kristalliseert in kleurloze tot lichtbeige schilferige kristallen, die een blauwe fluorescentie hebben en gemakkelijk sublimeren. Ze smelten in zuivere vorm bij 216,3°C. Antraceen is in water amper oplosbaar, slecht oplosbaar in ethanol en di-ethylether, maar goed in verwarmde benzeen. Antraceen ruikt weliswaar aromatisch, maar de geur is zwak. Daar antraceen slechts in één aromatische ring 6 elektronen in het pi-systeem heeft, is antraceen zeer reactief, in het bijzonder op de 9- en 10-posities. Het is reactiever dan de isomeer fenanthreen. Deze reactiviteit wordt gebruikt in bijvoorbeeld de oxidatie tot antrachinon. Onder invloed van licht dimeriseert antraceen tot het dimeer, dat weer door verhitting ontleed kan worden tot antraceen:
Antraceen is een organische halfgeleider. De emissielijn ligt tussen 400 en 440 nm.
Voorkomen en toepassingen
bewerkenAntraceen komt van nature voor in steenkoolteer, waar de naam ook vandaan komt. De antraceenfractie wordt bij destillatie van het teer opgevangen tussen 300 en 350°C. Antraceen wordt vrijwel alleen omgezet tot antrachinon dat een belangrijk intermediair is voor de productie van kleurstoffen en de basis vormt voor kleurstoffen als alizarine en indantreen. De oxidatie wordt uitgevoerd met waterstofperoxide of met vanadylacetylacetonaat. Tevens wordt het gebruikt als uitgangsstof voor de productie van stoffen voor insecticides en looimiddelen.
Externe links
bewerken- (en) MSDS van antraceen
- (en) Gegevens van antraceen in de GESTIS-stoffendatabank van het IFA
