Heemverbinding
Heemverbindingen (ook wel als haem geschreven) zijn complexe verbindingen met een centraal ijzerion en een porfyrinemolecuul als ligand. De bekendste verbinding is Fe-protoporfyrine IX, ook wel heem b genoemd of kortweg heem.
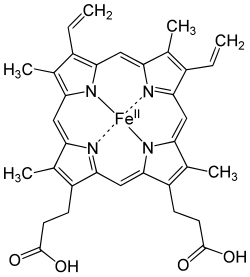

Heemverbindingen komen als co-factor (prosthetische groep) voor in eiwitten, die cytochromen genoemd worden, zoals in cytochroom A3, dat heem a bevat.
Ook zijn er heemverbindingen zonder ijzer zoals bij hematoporfyrine en chlorofyl. Bij chlorofyl of bladgroen is het ijzerion vervangen door een magnesium-ion.
Structuur
bewerkenEr zijn verschillende heemverbindingen, die zich van elkaar onderscheiden door de porfyrinestructuur. Er zijn o.a. heem a, heem b, heem c, heem o, heem l, heem m en heem s
| Heem a | Heem b | Heem c | Heem o | |
|---|---|---|---|---|
| PubChem Nummer | 7888115 | 444098 | 444125 | 6323367 |
| Brutoformule | C49H56O6N4Fe | C34H32O4N4Fe | C34H36O4N4S2Fe | C49H58O5N4Fe |
| functionele groep aan het C3-atoom | Hydroxyfarnesyl | -CH=CH2 | -CH-(CH3)-SH | Hydroxyfarnesyl |
| functionele groep aan het C8-atoom | -CH=CH2 | -CH=CH2 | -CH-(CH3)-SH | -CH=CH2 |
| functionele groep aan het C18-atoom | -CH=O | -CH3 | -CH3 | -CH3 |
Voorkomen
bewerkenHeem b komt als ijzerhoudende kleurstof voor in de rode bloedcellen. Het samen met rode bloedcellen voorkomende eiwit globine vormt het hemoglobine, dat een centrale rol speelt bij de zuurstofopname van het lichaam.
| Holoproteïne | Heemgroep (in monomeer) |
|---|---|
| Hemoglobine | Heem b |
| Myoglobine | Heem b |
| Katalase | Heem b |
| Succinaat-dehydrogenase | Heem b |
| Cytochroom-c-reductase | 2x Heem b, Heem c |
| Cytochroom-c-oxidase | 2x Heem a |
| Cytochroom-c-peroxidase | Heem b |
| Cytochroom P450-oxidase | Heem b |
Biosynthese
bewerkenHeem wordt met behulp van acht enzymen gevormd. De eerste en laatste drie enzymen bevinden zich in de mitochondria, terwijl de tussenliggende enzymen in het cytoplasma aanwezig zijn. In het menselijk lichaam gaat de biosynthese van alle heemverbindingen uit van succinyl-CoA en het aminozuur glycine. De δ-aminolevulinezuursynthase katalyseert de binding van glycine en succinyl-CoA tot α-amino-β-ketoadipaat, dat spontaan naar δ-aminolevulinezuur decarboxyleerd. δ-Aminolevulinezuur diffundeert naar het cytoplasma en door δ-aminolevulinezuur dehydrase condenseren twee δ-aminolevulinezuurmoleculen tot porfobilinogeen. Vier van deze moleculen worden door het PBG-desaminase enzym onder afsplitsing van vier ammoniakmoleculen in hydroxymethylbilaan omgezet. Hydroxymethylbilaan wordt vervolgens gepolymeriseerd tot uroporfyrinogeen III.
Verdere synthese vindt stap voor stap plaats door omzetting van uroporfyrinogeen III (PBG-isomerase) en coproporfyrinogeen III (uroporfyrinogeendecarboxylase) in protoporfyrinogeen IX (coproporfyrinogeen-oxidase) en protoporfyrine IX (protoporfyrinogeen-oxidase). Als laatste stap bouwt het ferrochelatase enzym nog een tweewaardig ijzerion in en is de heemverbinding af.
Pathologie: Bij praktisch elk betrokken enzym kan een defect ontstaan wat aanleiding is tot een typisch subtype van porfyrie.
Heem, een prosthetische groep in veel eiwitten, is betrokken bij een groot aantal biologische functies, zoals zuurstof- en elektronentransport, H2O2-(de-)generatie, verschillende oxidaties en de synthese van cyclisch guanosinemonofosfaat en stikstofoxide (NO). Daarnaast is heem betrokken bij de regulatie van de eiwitsynthese en celdifferentiatie.
Belangrijke heembevattende eiwitten zijn hemoglobine, myoglobine, cytochromen aa3, b en c3, cytochroom P450 oxidasen, peroxidasen, peroxidesynthase, katalase, tryptofaanpyrrolase, NO-oxidase en indolamine dioxigenase (9-12).
De cytochroom P450 oxydasen zijn enzymen, die onder anderen steroïden, galzure zouten, vetzuren, aminozuren, prostaglandinen, leukotriënen, biogene aminen, medicijnen, carcinogene en mutagene stoffen en contaminanten uit het milieu oxidatief metaboliseren (13,14).
Afbraak en uitscheiding
bewerkenDe afbraakproducten van de heemverbindingen zijn de galkleurstoffen en worden door de lever via de gal uitgescheiden.
Genen
bewerkenDe volgende genen zijn betrokken bij de synthese van heem:
- ALAD: aminolevulininezuur, delta-, dehydratase
- ALAS1: aminolevulinaat, delta-, synthase 1
- ALAS2: aminolevulinaat, delta-, synthase 2
- CPOX: coproporfyrinegen oxidase
- FECH: ferrochelatase
- HMBS: hydroxymethylbilaan-synthase
- PPOX: protoporfyrinegen oxidase
- UROD: uroporfyrinegen decarboxylase
- UROS: uroporfyrinegen III synthase