Joodtrifluoride
Joodtrifluoride is een anorganische verbinding met de formule . Het is een gele vaste stof die boven −28 °C ontleedt. Het is mogelijk de stof uit de elementen te synthetiseren, maar de omstandigheden moeten goed in de hand gehouden worden: joodpentafluoride () wordt makkelijk gevormd.
| Joodtrifluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
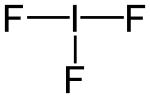
| ||||
Structuurformule van
| ||||

| ||||
Ruimtelijk model van
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Joodtrifluoride | |||
| Andere namen | Jood(III)fluoride | |||
| Molmassa | 183,9 g/mol | |||
| SMILES | FI(F)F
| |||
| CAS-nummer | 22520-96-3 | |||
| PubChem | 13932268 | |||
| Wikidata | Q419600 | |||
| Beschrijving | gele vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Fysische eigenschappen | ||||
| Kleur | geel | |||
| Smeltpunt | (ontleed) -28 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
bewerkenF2 reageert met I2 bij −45 °C in CCl3F waarbij gevoermd wordt. Een alternatieve syntheseroute, ook bij lage temperatuur gaat uit van en (xenondifluoride).
Structuur van het molecuul
bewerkenDe structuur van lijkt sterk op die van broomtrifluoride, het vormt elektronisch gezien ook een trigonale bipiramide, met twee fluor-atomen op de toppen van de piramides en een in het equatoriale vlak. De andere twee equatoriale posities worden ingenomen door vrije elektronenparen.
Als alleen naar de atomen gekeken wordt heeft het molecuul het model van een "T".[1]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Iodine trifluoride op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.

