Tetramethylammoniumchloride
Tetramethylammoniumchloride is een quaternair ammoniumzout met als brutoformule C4H12NCl. De stof komt voor als witte, hygroscopische kristallen, die zeer goed oplosbaar zijn in water.
| Tetramethylammoniumchloride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
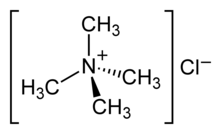
| ||||
Structuurformule van tetramethylammoniumchloride
| ||||
| Algemeen | ||||
| Molecuulformule | C4H12NCl | |||
| IUPAC-naam | tetramethylammoniumchloride | |||
| Andere namen | N-,N-,N-trimethylmethanamiumchloride, tetraminechloride | |||
| Molmassa | 109,59778 g/mol | |||
| SMILES | C[N+](C)(C)C.[Cl-]
| |||
| CAS-nummer | 75-57-0 | |||
| Wikidata | Q2667590 | |||
| Beschrijving | Witte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H300 - H311 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P264 - P280 - P301+P310 - P305+P351+P338 - P312 | |||
| Opslag | Gescheiden van oxiderende stoffen. Droog en goed gesloten bewaren. | |||
| VN-nummer | 2811 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| LD50 (ratten) | (oraal) 50 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,17 g/cm³ | |||
| Smeltpunt | 425 °C | |||
| Goed oplosbaar in | water | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
bewerkenTetramethylammoniumchloride wordt bereid door een alkylering van ammoniumchloride met dimethylcarbonaat:[1]
Toepassingen
bewerkenTetramethylammoniumchloride wordt gebruikt als additief in polymerase-kettingreacties (PCR), om het rendement te verhogen. Het kent ook toepassingen als oppervlakte-actieve stof. De stof is, net als ammoniumchloride, een zout. Het voordeel van het tetramethylzout ten opzichte van ammoniumchloride zelf is dat het niet zuur-base-actief is. Ook in de vorming van complexen is tetramethylammoniumchloride niet betrokken.
De stof wordt gebruikt als katalysator in bepaalde organische reacties, bijvoorbeeld de reactie van fenol of cresol met fosgeen tot carbonaatesters zoals difenylcarbonaat.[2] Tetramethylammoniumchloride is een polymerisatieversneller voor de polymerisatie van caprolactam tot nylon 6.[3]
Verder wordt het aangewend als reagens voor de productie van herbiciden.[4]
Tetramethylammoniumchloride is een uitgangsproduct voor de bereiding van tetramethylammoniumhydroxide door elektrolyse.[5]
Toxicologie en veiligheid
bewerkenDe stof ontleedt bij verhitting boven 300 °C met vorming van ammoniak, koolstofmonoxide, waterstofchloride en stikstofoxiden. Tetramethylammoniumchloride reageert met oxiderende stoffen.
De stof is irriterend voor de ogen, de huid en de luchtwegen. Ze kan effecten hebben op het centraal zenuwstelsel, met als gevolg duizeligheid en een verminderd bewustzijn.
Externe links
bewerken- tetramethylammoniumchloride - International Chemical Safety Card
- (en) MSDS van tetramethylammoniumchloride
- ↑ (en) Zheng Z. et al. - Alkylation of Ammonium Salts Catalyzed by Imidazolium-Based Ionic Liquid Catalysts[dode link], Advanced Synthetic Catalysis, 349 (7), pp. 1095-1101, 2007
- ↑ US Patent 2837555, "Preparation of carbonate esters" van 3 juni 1958 aan Dow Chemical
- ↑ US Patent 5859178, "Polymerization of caprolactam with certain quaternary ammonium compounds" van 12 januari 1999 aan Puritek Inc.
- ↑ Europees octrooi 0117337, "Method for preparation of salts of N-phosphonomethylglycine" van 5 september 1984 aan Stauffer Chemical Company
- ↑ U.S. Patent 4394226, "Electrolytic method for producing quaternary ammonium hydroxides" van 19 juli 1983 aan Thiokol Corp.
